歐盟醫療器材/體外診斷醫療器材法規系列課程.
本系列課程將以個別主題方式展張,帶你深入討論,並分享技術文件在審查上的重點與常見
歐盟醫療器材/體外診斷醫療器材法規 (以下簡稱MDR/IVDR),分別於2021年與2022年五月底開始正式實施。歐盟公告機構也陸續開始接受廠商申請MDR/IVDR符合性評估(CE認證)。歐盟醫療器材/體外診斷醫療器材法規 (以下簡稱MDR/IVDR),分別於2021年與2022年五月底開始正式實施。歐盟公告機構也陸續開始接受廠商申請MDR/IVDR符合性評估(CE認證)。

歐盟醫療器材/體外診斷醫療器材法規系列課程
課程型態/ 混成(實體+線上同步)
上課地址/ 工研院光復院區1館,實際地點以上課通知單為主
時數/ 49小時
起迄日期/ 2023/05/26~2024/01/12
聯絡資訊/ 陳小姐 03-5732407
報名截止日/ 2024/01/10

課程介紹
歐盟醫療器材/體外診斷醫療器材法規 (以下簡稱MDR/IVDR),分別於2021年與2022年五月底開始正式實施。歐盟公告機構也陸續開始接受廠商申請MDR/IVDR符合性評估(CE認證)。
過程中廠商會遇到兩個重要的活動:品質系統稽核 (QMS audit)、技術文件評估 (TD assessment)。這兩個活動會在CE認證的過程中平行地進行,並互相影響。例如,技術專家看到的技術文件的缺失,稽核員於品質系統稽核會注意相關的程序與紀錄,甚至廠內人員的資格與能力。
而MDR/IVDR在品質系統的法規要求更多於ISO 13485。按照ISO 13485,能幫助廠商建立一個品質系統的架構 (framework),但13485並未詳細指出特定國家或是區域的法規要求。所以滿足了ISO 13485並不代表滿足MDR/IVDR品質系統的要求。本系列課程將解析MDR/IVDR品質系統要求,並討論在程序上實務可行的做法,讓你理解該如何著手修改品質系統文件。
在技術文件架構與內容上的要求提高了不少,舉凡設計製造、安全與效能、風險管理包含利益風險分析、可用性工程、臨床評估、上市後臨床追蹤、上市後監督、上市後定期安全更新報告…等都有非常多的改變。本系列課程將以個別主題方式展張,帶你深入討論,並分享技術文件在審查上的重點與常見缺失。
接著是法規符合性負責人(PRRC),MDR/IVDR要求一定規模以上的製造商,其組織中要有專職專責並確認其符合的資格。組織須委任PRRC、定義其責任與描述其工作內容,在EUDAMED 將PRRC與製造商的資訊一起註冊進去。PRRC主要負責組織5大方向之法規符合性,並在稽核時提供程序與紀錄以證明法規符合性。
以往課程在受限在短的時間內,只能以概述、簡介方式帶過艱澀的法規條文,即使翻譯成中文,因為沒有與實務結合,也不容易理解法規的要求。
講師將依據自己多年累積的案件輔導經驗,開發此系列課程,讓學員來學習以本質思考的方式來詮釋法規要求的內含。
講師依據研究資料與輔導經驗設計出本系列課程,其初衷是為了讓學員來體會如何以思考的方式來詮釋法規內容,看出條文背後真正的科學意義,而不只是文字表面的意思。本課程將MDR/IVDR分為8個的主題模組,學員可以分開不同主題課程各別學習。
*工研院產業學院為衛福部核可辦理醫材人員訓練及認證之合格單位,本課程完訓後可申請時數認證,惟實際申請仍以衛福部查核結果為準,敬請學員踴躍報名。
*為因應疫情防疫規定,本場次課程將以「實體舉辦」為主,後續將視中央疫情規定保留調整為「全線上辦理」之權利,實際上課資訊請依上課通知為準。
課程目標
− 協助企業培養專業專責的『法規遵循(符合性)負責人PRRC』
課程對象
— 歐盟醫療器材法規與品質系統已有扎扎實實2年(MDD也算)以上經驗
— 有好好閱讀過 MDR或IVDR重要的條文,平常遇到問題會習慣回到條文裡面再看一次
講師簡介
俞力平 博士(Irving Yu)
− 樂證科技 資深顧問 / 法規顧問部副總
− 醫療器材法規小學堂![]() FB粉絲頁面經營管理
FB粉絲頁面經營管理
− 學歷:生物醫學影像暨放射科學系 博士
− 專長:歐盟MDR/IVDR、風險管理、可用性工程、設計管制、上市後監督
− 授課經驗: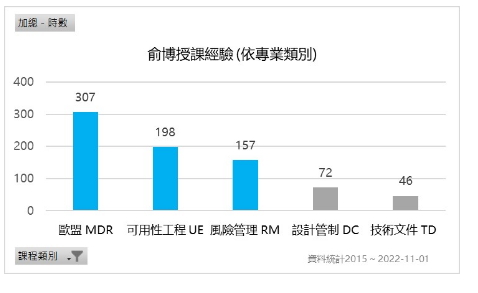
胡齡月 博士(Ling-Yueh, Moony, Hu)
− 樂證科技 臨床部資深顧問 / 總監 (臨床評估暨臨床事務)
− 經歷: 財團法人生物技術開發中心 轉譯醫學研究室臨床研究組組長
− 專長:醫療器材臨床評估、臨床試驗設計、PMCF
•具豐富的臨床評估報告(MEDDEV 2.7/1 Rev 4)撰寫經驗,協助多家廠商成功通過MDR臨床評估報告審核。
•提供高品質的臨床評估及PMCF整體規劃、報告撰寫及顧問服務。
賴韋滄 顧問(Wes Weitsang Lai)
− 樂證科技 專業顧問
− 學歷:材料科學與工程學系 碩士
− 經歷:工業技術研究院 生醫與醫材研究所
醫療器材製造廠 研發/滅菌主管
塑膠工業技術發展中心 醫妝試驗組
高分子混煉改質廠 研究員/實驗室主管
− 專長:品質管理系統、設計管制、查證與確效、滅菌製程、機械/化學性質分析、微生物檢驗、無塵室製程規劃
陳顧問
− 醫療器材法規輔導顧問師 / 合作專業講師
- 生技、工程、管理3碩士
− 具醫療器材廠經驗超過15年,領域涵蓋管理代表、研發、 法規、工程、製造、品管、PM、資材與協助業務產品推廣。
− 專長:品質管理系統、查驗登記、設計開發與設計管制、製程確效等。
課程大綱
|
課程日期 |
課程主題 |
課程內容 |
講師 |
課程 時數 |
|
4/14 (五) MDR/IVDR |
CE-01:醫療器材MDR/IVDR品質管理系統 |
1. ISO 13485 品質系統介紹 2. MDR Annex IX, Ch 1 & 3* 品質系統的要求 3. MDR QMS requirement checklist 實作 *不含 Annex IX, Ch 2 TD assessment |
陳顧問 俞力平 博士 |
6小時 |
|
6/2 (五) MDR |
CE-02:醫療器材MDR技術文件結構、內容與細節上的要求 |
1. 設計歷史檔案 (DHF)、產品生產主檔案 (DMR) 與技術文件 (TD) 的關係。 2. 技術文件的要求與架構 3. 詳細說明每一個技術文件章節的內容。 4. 內容彙整各家NB出版的TD submission guideline與美國FDA的指引 |
俞力平 博士 |
7小時 |
|
7/7 (五) MDR/IVDR |
CE-03:醫療器材上市後監督系統 (PMS) |
1. MDR/IVDR上市後監督的要求 2. 上市後監督程序、計畫、上市後監督報告、上市後定期安全更新報告(PSUR)。 3. 趨勢分析/監控與通報 (trend analysis/monitor and report) 4. 上市後監督常見的不符合的事項 (Common Issues or Nonconformity) 5. 內容彙整ISO TR 20416:2020上市後監督指引 6. MDCG PSUR (draft) guidance |
俞力平 博士 |
6小時 |
|
7/28 (五) MDR/IVDR |
CE-04:醫療器材警戒系統 (Vigilance) |
1. 警戒系統,包含嚴重事件通報、市場安全矯正行動(FSCA & FSN)、趨勢報告(Trend Report)、定期總結報告(Periodic Summary Report)。 2. MEDDEV 2.12 rev 8 + 2019 additional guidance + new MIR form v7.2.1b 3. MDCG Vigilance guidance (如開課前有發佈將更新至課程內容中) |
俞力平 博士 |
6小時 |
|
9/15 (五) MDR |
CE-05:醫療器材製造商提供的資訊與說明書 |
1. MDR GSPR 23產品標籤與說明書67個次項的要求 2. ISO 15223-1:2021標籤使用的符號 3. ISO 20417:2021製造商提供的信息 4. 補充美國FDA對於患者使用資訊/說明書的要求 |
賴韋滄 顧問 |
6小時 |
|
10/13 (五) MDR |
CE-06:MDR高風險醫療器材相關的臨床要求 |
1. MDR Article 61臨床評估條文的討論 2. 製造商提供給病患的資訊與植入物卡片(implant card)內容說明與設計 3. 安全性及臨床效能摘要(SSCP)內容說明與撰寫 |
俞力平 博士 |
6小時 |
|
10/27 (五) MDR |
CE-07:如何撰寫符合歐盟審查要求的醫療器材臨床評估報告 |
1. 解說EU MDR對臨床評估要求的相關法規條文 - 建立臨床評估的核心概念 2. 介紹臨床評估流程 (MEDDEV 2.7/1 rev. 4) 及臨床評估報告文件架構 (Clinical Evaluation Report, CER) 3. 如何規劃及撰寫臨床評估計畫 (Clinical Evaluation Plan, CEP) 與臨床開發計畫 (Clinical Development Plan, CDP) 4. 臨床評估方法:臨床試驗資料要求、實質等同表 (Equivalence table) 撰寫要點 5. 系統性收集、彙整及分析臨床資料 (Clinical Data) - 技術文件間的串聯 6. 符合MDR審查要求的臨床文獻搜尋經驗分享 7. 臨床評估文件常見審查缺失與預防 - 實戰經驗分享 |
胡齡月 博士 |
6小時 |
|
11/24 (五) MDR |
CE-08:醫療器材上市後臨床追蹤 (PMCF) |
1. 從臨床評估的要求鑒別PMCF的需求 2. PMCF活動類型簡介 3. PMCF plan文件架構說明與撰寫重點 4. PMCF evaluation report文件架構說明與撰寫重點 5. PMCF study送審臨床試驗文件重點說明 6. PMCF活動經驗分享 |
胡齡月 博士 |
6小時 |
※ 執行單位保留調整課程內容之權利
課程特色
- 非制式法規條文講解。
- 深入淺出講課方式適合相關學、經歷背景及各類職務之學員。
- 透過舉例說明、分析條文、案例討論,帶您學習。
本課程分為 8 個主題,可自由挑選合適主題受訓
- 4/14 (五) 醫療器材MDR/IVDR品質管理系統(共6小時)
- 6/2 (五) 醫療器材MDR技術文件結構、內容與細節上的要求(共7小時)
- 7/7 (五) 醫療器材上市後監督系統 (PMS)(共6小時)
- 7/28 (五) 醫療器材警戒系統 (Vigilance) (共6小時)
- 9/15 (五) 醫療器材製造商提供的資訊與說明書(共6小時)
- 10/13 (五) MDR高風險醫療器材相關的臨床要求(共6小時)
- 10/27 (五) 如何撰寫符合歐盟審查要求的醫療器材臨床評估報告(共6小時)
- 11/24 (五) 醫療器材上市後臨床追蹤 (PMCF)(共6小時)
課程售價
n 6小時課程
特惠價:每人$5,600元整 (原價$6,700元)
早鳥優惠價:開課前14天報名優惠價:每人$5,300元整
工研人優惠價:每人$ 5,200元整
同單位2人團報優惠價:每人$ 4,900元整
同單位3人(含以上)團報優惠價:每人$ 4,560元整n 7小時課程
特惠價:每人$6,500元整 (原價$7,600元)
早鳥優惠價:開課前14天報名優惠價:每人$6,200元整
工研人優惠價:每人$ 6,100元整
同單位2人團報優惠價:每人$ 5,700元整
同單位3人(含以上)團報優惠價:每人$ 5,320元整付款方式
貼心提醒
產業學院緣起
依據行政院「挑戰2008:國家發展重點計畫」下之「國際創新研發基地」與「產業高值化」兩計畫,首重產業科技人才的效能。
•911216經科字第09103373120號函:經濟部將本院籌設工研院產業學院之工作,列為因應產業結構轉型,提 ... more







